Essais de reproduction en aquarium d'Amphiprion ocellaris, par Alain Bertschy.
Introduction et présentation de l'auteur.
 Cet article sur la reproduction d'Amphiprion ocellaris Cuvier (Pomacentridés) a été écrit par Alain Bertschy (à ce jour, "patron" d'Aquarium Systems France), en 1979 et publié dans la
Revue Française d'Aquariologie et d'Herpétologie au cours du 3ème trimestre 1979. Malgré son ancienneté, le texte garde,
aujourd'hui encore, toute sa valeur. Et aucun besoin de rose des vents ni de boussole pour s'y retrouver : tout est simple.
Cet article sur la reproduction d'Amphiprion ocellaris Cuvier (Pomacentridés) a été écrit par Alain Bertschy (à ce jour, "patron" d'Aquarium Systems France), en 1979 et publié dans la
Revue Française d'Aquariologie et d'Herpétologie au cours du 3ème trimestre 1979. Malgré son ancienneté, le texte garde,
aujourd'hui encore, toute sa valeur. Et aucun besoin de rose des vents ni de boussole pour s'y retrouver : tout est simple.
Amphiprion ocellaris Cuvier a été généralement confondu avec Amphiprion percula Lacepède, jusqu'à la révision de Gerald R. Allen (1972). Importée en Europe dès 1912 (Berlin), cette espèce fut aussi la première du genre à se reproduire en captivité (3 jeunes
élevés à l'Aquarium d'Onrust dans la baie de Djakarta, sur plusieurs milliers de larves écloses, Verwey, 1930). J. Garnaud (1951) constata que la ponte pouvait avoir lieu en l'absence d'anémone, mais ne put amener aucune larve au delà d
u 6ème jour. O. Koenig (1960) réussit l'élevage de 16 alevins et fut suivi par des Aquariums Publics (Wilhelma) et quelques amateurs (voir liste bibliographique).
Depuis 1974, l'espèce est élevée en Floride, sur plusieurs générations (Anonyme, 1976). Gerald R. Allen (loc. cit.) écrit qu'elle est probablement l'espèce la plus favorable pour des tentatives de reproduction; elle se contente pour pondre
d'un bac de dimensions modestes (15 gallons, soit 57 litres environ) et, de plus, elle est prolifique (jusqu'à 28 pontes par an à l'Aquarium Artis, selon de Graaf, (1977). Le nombre des oeufs paraît excessivement variable (de 280 à près de 1500, Garnaud loc. cit.).
Les protocoles d'élevage n'ont pas tous été publiés, ceux du secteur commercial en particulier où les réussites seraient de l'ordre de 90%, et ceux qui ont fait l'objet de notes ne permettent pas de dégager une méthode, à la fois simple et fiable, qui comporterait des chances raisonnables de réussite.
Nous décrivons, à notre tour, une série de tentatives au cours desquelles 3 pontes du même couple, sur les 10 prélevées, ont permis d'amener 30 spécimens en tout, au delà de la phase larvaire qui dure une dizaine de jours à 26 °C.
Matériel et méthodes pour la reproduction d'Amphiprion ocellaris.
Couple reproducteur.
Le couple est constitué d'un mâle âgé de plus de 5 ans (acquis juvénile en octobre 1973) et d'une femelle issue d'un lot de 10 juvéniles, acquis en janvier 1978, dont 7 sont morts pendant la période d'acclimatation. Des 3 survivants, 2 ont conservé sensiblement leur taille d'origine d'environ 40 mm
(inhibition sociale), le 3e a présenté, au contraire, une croissance rapide et s'est apparié au mâle en novembre 1978. Longueurs totales (LT) respectives au 30 mai 1979 : mâle 73 mm ; femelle 65 mm (cf. les 2 photos).
En valeur absolue, la taille des femelles dépasse celle des mâles (110 et 80 mm LT, de Graaf, loc. cit.; max. 74,5 mm LS, Allen), et, dans la nature, le couple reproducteur est formé de la plus
grande femelle du groupe et du mâle de plus haut rang, qui sera néanmoins plus petit qu'elle. Il en est généralement de même en aquarium recifal
(Egensperger et Condé, fiche aquariologique Amphiprion ocellaris, supp. Revue Française Aquariologie (1976), mais parfois un couple, comme c'est le cas ici, peut
présenter un rapport inverse en fonction d'âges très différents.
Burgess (1975) écrit que la reconnaissance des sexes serait possible d'après la forme de la 2e bande blanche, et on s'intéressera aux évidentes possibilités des apports de
plantes d'aquarium pour recréer un paysage terrestre en aquarium d'eau de mer. Celle-ci est plus large chez la femelle que chez le mâle et l'expansion en forme de coin du bord antérieur est plus développée chez la première que chez le second; en conséquence, la distance séparant le sommet de
la pointe de la 2e bande, de la marge postérieure de la 1ère, est relativement plus courte chez la femelle que chez le mâle. De Graaf (1977) a constaté le même
dimorphisme sexuel chez tous les couples qui ont pondu à l'Aquarium Artis et cette différence se vérifie aussi chez notre couple. Selon
Garnaud (1951) néanmoins, la seconde bande blanche, particulièrement variable, n'a aucune valeur discriminative;
il mentionne en revanche une large tache noire à l'insertion des pectorales chez le mâle (absente chez notre spécimen).
Alimentation des Amphiprion ocellaris.
 Moule crue ou cuite, Crevettes, parfois Néreis et nourriture sèche.
Moule crue ou cuite, Crevettes, parfois Néreis et nourriture sèche.
Dans le bac de ponte, les 4 spécimens cohabitent dans un bac de 220 litres d'eau de mer reconstituée (sels H.W.), filtré sur une gouttière chargée de perlon et de mousse polyéther, et alimentée par un exhausteur d'un débit d'environ 600 l/h, pourvu de deux diffuseurs d'air et d'un écumeur, éclairé
par 2 tubes Gro-Lux de 40 W et décoré de roches en polystyrène recouvrant de quartzite et de fragments de Madrépores; température moyenne 27 °C. Abondante plantation de Caulerpa prolifera.
Une Radianthus sp. (probablement Radianthus malu), des Actinia equina et des Aiptasia sp. complètent le peuplement, mais pas de méduse
Aurelia aurita.
Pontes des Amphiprion ocellaris.
La première, observée le 26 novembre 1978, fut suivie de 9 autres, à des intervalles de 10 à 12 jours. Toutes furent déposées sur le décor en polystyrène, ce qui rendait difficile le prélèvement des oeufs. La première se trouvait à 50 cm de la Radianthus, toutes les autres à son voisinage immédiat. Les pontes ont eu lieu, en général, en fin d'après-midi; leur durée était d'environ 1 heure; les oeufs, de couleur jaune clair, au nombre de 200 à 300, sont ovalaires, ca. 1,60 sur 1,20 mm. L'incubation dure 8 jours à 27 °C; l'éclosion se produit quelques heures après l'extinction des tubes et se termine avant le matin, sauf pour une ponte (la 5e) où elle s'est étalée sur 3 jours ( tableau I).
Bac d'élevage des Amphiprion ocellaris.
Les 3 premières pontes ont été isolées dans un récipient en plastique d'environ 1,5 l dont le fond était remplacé par un tissage nylon recouvert d'un peu de sable, le tout plongé dans le bac des parents. Aucun succès au-delà de
35 heures. A partir de la 4e ponte, on a utilisé un bac en verre collé, avec filtre intégré qui correspond au schéma ci-dessous. La capacité totale est de 200 litres, l'enceinte recevant les alevins renferme environ 25 litres et
les mailles du tissage nylon qui constitue le plancher laissent passer les nauplies d'Artémias fraîchement écloses, ce qui semble un inconvénient. De plus, des alevins de la 9e ponte se sont pris dans le fond du bac d'élevage,
entre le renfort en verre et le tissage nylon; pour pallier à cet inconvénient, le fond a été recouvert d'une mince couche de sable. Le débit de l'exhausteur est de 600 l/h; une partie de cette eau est rejetée dans le bac des
alevins, tandis que le reste, par l'intermédiaire d'un té plastique réglable, est rejeté dans l'aquarium.
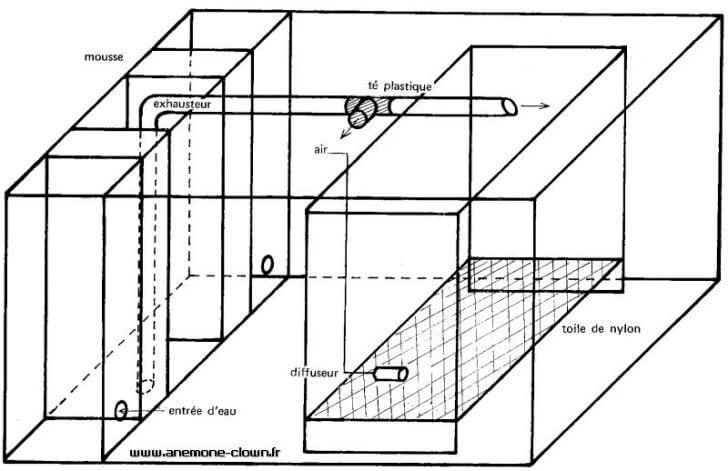
La température était de 26 °C pour les pontes n° 4 à 8, de 27-28 °C pour les 2 dernières.
L'eau du bac d'élevage n'est pas prélevée dans le bac des parents; elle résulte du mélange de 1/3 d'eau neuve et de 2/3 d'eau d'un aquarium de 1000 litres en fonctionnement. Sa teneur en nitrites et nitrates n'a pas pu être mesurée avec précision, mais elle est certainement très faible, compte tenu du remplacement journalier, dans le bac d'élevage, de 10 l d'eau par de l'eau neuve (préparée 8-15 jours d'avance), ceci pendant les premiers jours au moins. Densité voisine de 1020 à 27-28 °C.
Procédures pour élever les alevins de poisson-clown.
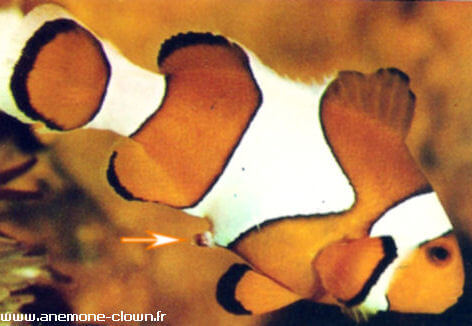 Les oeufs sont prélevés quelques heures avant l'éclosion par grattage du site de ponte à l'aide d'une pipette en verre à extrémité tranchante. Ils sont aspirés par succion, ou par siphonnage, cette dernière méthode plus rapide,
mais apparemment plus choquante. Placés à mesure dans un récipient en plastique d'environ 1 litre, flottant sur l'eau du bac de ponte, les oeufs sont comptés et triés (élimination des oeufs lésés). Ils sont ensuite transvasés
dans le petit compartiment du bac d'élevage.
Les oeufs sont prélevés quelques heures avant l'éclosion par grattage du site de ponte à l'aide d'une pipette en verre à extrémité tranchante. Ils sont aspirés par succion, ou par siphonnage, cette dernière méthode plus rapide,
mais apparemment plus choquante. Placés à mesure dans un récipient en plastique d'environ 1 litre, flottant sur l'eau du bac de ponte, les oeufs sont comptés et triés (élimination des oeufs lésés). Ils sont ensuite transvasés
dans le petit compartiment du bac d'élevage.
Avec l'éclosion commencent les difficultés pour bien nourrir les alevins. Après divers essais dont le meilleur a donné un taux de réussite de
36,66% (22 alevins sur 60 oeufs), nous pouvons proposer la méthode suivante, testée à 28 °C. Les 2 premiers jours, on distribue, toutes les heures diurnes, un mélange de Mikrozell, Liquizell et TetraMin, préparé dans un verre
d'eau de l'aquarium. Le débit du filtre, dans le compartiment des alevins, est réduit au moment de la distribution et rétabli, au maximum, un peu avant la distribution suivante, pour assurer un bon renouvellement de l'eau.
Au 3ème jour (ou même dès 1 jour 1/2 pour certains alevins) on distribue, 3 fois par jour, des nauplies d'Artémias à l'éclosion; l'addition simultanée de Mickrozell ou de Liquizell semble stimuler les alevins et les
inciter à avaler les nauplies.
Les pertes qui sont ordinairement très importantes pendant les 3 ou 4 premiers jours, régressent à partir du 5e ; dès ce moment, on peut espérer un succès d'élevage.
La "métamorphose" intervient, selon la température et peut-être l'alimentation, entre le 8e et le 12e jour, avec l'apparition, un peu décalée, des 2 bandes claires antérieures sur fond orange et de la nage ondulante caractéristique;
les modifications sont ensuite progressives vers l'acquisition d'un patron de coloration qui se rapproche de plus en plus de celui de l'adulte (du 12e au 20e jour : 9 mm), puis lui devient identique (du 20e au 80e : 14 mm au 40e
jour, 16 mm au 60e).
Remarques : L'usage d'Euplotes (souche du Wilhelma Aquarium), essayé pour les 7 premières pontes, a été ensuite abandonné (un seul succès pendant cette période). Nous ne pouvons cependant affirmer qu'il ne restait aucun de
ces Ciliés dans le bac d'élevage, malgré la température élevée qui leur est défavorable.
II est possible que l'introduction de Mikrozell, Liquizell et Tetra-Min dans le bac, lors de chaque ponte, ait favorisé à la longue le développement d'une microfaune convenant à l'alimentation des alevins des deux dernières pontes.
Tableaux des pontes d'Amphiprion
| n° des pontes | dates | oeufs prélevés | éclosions | longévité des larves |
| 1 | 26.11.1978 | totalité | 04.12.1978 | 10 h |
| +- 250 | ||||
| 2 | 05.12.1978 | totalité | 13.12.1978 | 20 h |
| 3 | 17.12.1978 | totalité | 25.12.1978 | 35 h |
| 4 | 27.12.1978 | 40 | 04.01.1979 | 4 alevins menés à terme |
| 5 | 10.01.1979 | 200 | 17.01.1979 4% | |
| 18.01.1979 30% | 2 - 3 jours | |||
| 19.01.1979 45% | ||||
| 6 | 20.01.1979 | 100 | 28.01.1979 | 3 jours |
| 7 | 01.02.1979 | 75 | 09.02.1979 | 3 jours |
| 8 | 12.02.1979 | 60 | 20.02.1979 | 1 jour |
| 9 | 24.02.1979 | 100 | 04.03.1979 | 4 alevins à terme |
| 10 | 07.03.1979 | 60 | 15.03.1979 | 22 alevins à terme |
|
Tableau II
(4ème ponte : éclosion et pertes sur 40 œufs prélevés. 26 °C.)
|
Tableau III
(9ème ponte : éclosions et pertes sur 60 des 100 oeufs prélevés. 27 - 28 °C.)
|
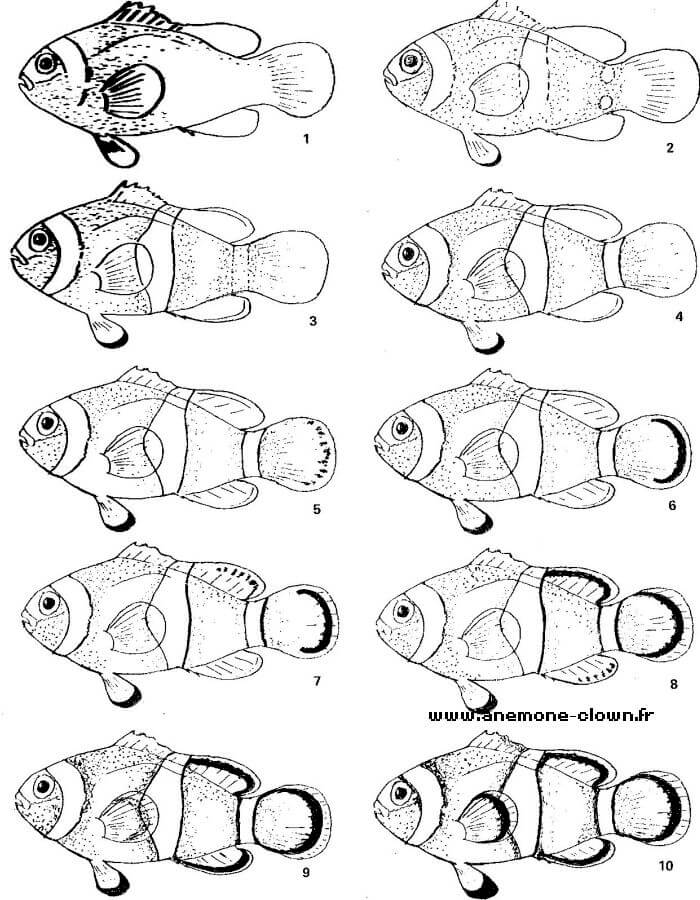
Evolution du patron de coloration semi-schématique des alevins Amphiprion ocellaris.
Note: tous les alevins sont ramenés à la même dimension! (cliquez pour obtenir un agrandissement.)
|
|
(1) Quelques individus sont en retard sur cette chronologie; les longueurs indiquées ont été mesurées sur des spécimens morts qui n'étaient pas toujours les plus grands alevins; elles sont données à titre indicatif. Le développement décrit par Hackinger (1962) paraît très retardé dans la réalisation du patron.
Bibliographie sur la reproduction des Amphiprion ocellaris.
- Anonyme, 1976. - On rearing the fry of marine tropicals. Trop. Fish Hobb.
- Allen (G.R.), 1972. - The Anemonefishes, their Classification and Biology. T.F.H. Publ., Inc. LUI., Neptune City. (avec une bibliographie de 207 titres).
- Bruinenberg (W.), 1975. - Aufzucht von Amphiprion ocellaris (Amphiprion percula). T.L (Tats. u Inform. Aquarist.).
- Burgess (W.E.), 1975. - Salts from the Seven Seas. Trop. Fish Hobb.
- Graaf (F. de), 1977. - Encyclopédie des Poissons d'aquarium marin. Ed. française, Elsevier-Séquoia, Paris-Bruxelles.
- Hackinger (A.), 1962. - Die Entwicklung der weissen Streifenzeichnung bei Amphiprion percula. Die Pyramide, Wien.
- Hackinger (A.), 1967. - Anemonenfische in Aquarium gezüchtet. Die Aufzucht von Amphiprion bicinctus im Aquarium. Aquar. Mag.
- Meulengracht-Madsen (J.), 1971. - Breeding Amphiprion percula. Trop. Fish Hobb.
- Mitsch (H.), 1941. -Breeding of clown fishes (Amphiprion percula). The Aquarium, Philadelphia.
- Moe (M.AJr.), 1973. - Breeding the clownfish Amphiprion ocellaris. Salt Water Aquarium.
- Springman (W.), 1963. -Misslungene Zucht von Amphiprion percula. DATZ.
Présentation de Fabien ALberti, alias "Fab88" sur Internet.
Fabien Alberti était responsable "aquariophilie" de l'enseigne Nilufar, et dirige depuis 2014 la société de vente de coraux, incluant les anémones de mer, FabCorail.com. Nous le rencontrons sur Internet sous le pseudo Fab88; En 2003, il a écrit l'article suivant sur la
la reproduction des poissons-clowns :
Étant passionné de reproduction depuis mon plus jeune âge, j'ai reproduit pas mal de poissons d'eau douce (killies, cichlidés africains, discus, etc...), ensuite quand la folie récifale m'a pris, j'ai vite installé une batterie destinée à la reproduction des coraux, enfin plutôt à leur propagation. Mais par
défi, je voulais reproduire des poissons marins, j'ai donc arrêté mes installations de multiplication de coraux pour y héberger les poissons destinés à la reproduction. J'ai profité d'avoir un couple de poissons-clowns pondant régulièrement chez mon père, avec des éclosions systématiques, pour essayer de les reproduire, comme dans la vie des algues.
Installation des géniteurs Amphiprion ocellaris.
En tant qu'aquariophile, j'ai donc connecté à mon aquarium récifal une installation de 3 bacs de 120 litres, pas d'eau douce heureusement, superposés les un sur les autres qui me permet de maintenir différents poissons.
Dans ces bacs il y a :
- le couple d'Amphiprion ocellaris et une dizaine de jeunes Pterapogon kauderni.
- Un couple d'Amphiprion bicinctus, le couple reproducteur de Pterapogon kauderni ainsi qu'un couple de Pseudochromis fridmani (qui ont déjà pondu 1 fois).
- 1 trio d'Hippocampus kuda, ainsi que 3 poissons feuilles (Taenianotus triacanthus).
La ponte :
La première ponte a eu lieu sur la vitre arrière, je n'ai donc pas pu récupérer une seule larve. Pour remédier à ce problème, j'ai disposé sur la vitre arrière des petites tuiles en terre cuite et mis des pots de fleurs
dans l'aquarium.
Résultat 15 jours après, ils pondaient dans un des pots de fleurs. Le couple de clown provient du bac de mon père, la femelle a 8 ans et le mâle 5 ans.
Chez moi la ponte s'est toujours déroulée en fin d'après-midi, les 2 premiers jours les œufs sont oranges clairs, ce qui ne se voit quasiment pas sur un pot de fleur, au bout de quelques jours ils commencent à s'assombrir, et on commence à voir les yeux des larves 3 jours avant l'éclosion.
L'éclosion parvient une semaine après la ponte et toujours après l'extinction des feux. Le rôle des géniteurs est bien précis, la femelle montant la garde autour de la ponte (les petits kaudernis n'ont qu'à bien se tenir) et le mâle prodiguant les soins à la ponte. Le soir avant l'éclosion, le mâle
est beaucoup plus actif, il nettoie et ventile la ponte.
Les protocoles d'élevage n'ont pas tous été publiés, ceux du secteur commercial en particulier où les réussites seraient de l'ordre de 90 %, et ceux qui ont fait l'objet de notes ne permettent pas de dégager une méthode, à la fois simple et fiable, qui comporterait des chances raisonnables de réussite.
Nous décrivons, à notre tour, une série de tentatives au cours desquelles 3 pontes du même couple, sur les 10 prélevées, nous ont permis d'amener 30 spécimens, en tout, au delà de la phase larvaire qui dure une dizaine de jours à 26 °C.